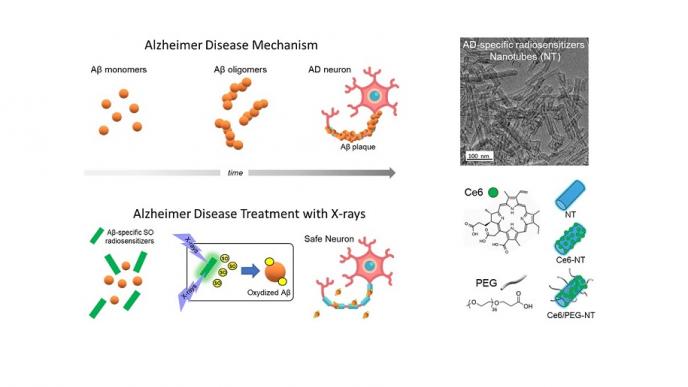
Il ripiegamento errato e l’aggregazione di alcuni tipi di proteine sono la causa fondamentale di diverse patologie degenerative come la malattia di Alzheimer, il morbo di Parkinson e il diabete di tipo II. In modo particolare alterazioni nel ripiegamento delle proteine amiloide-β (Aβ) e Tau giocano un ruolo importante nell’eziologia della malattia di Alzheimer, caratterizzata infatti dall’accumulo nel cervello di oligomeri e fibrille che determinano la morte selettiva delle cellule neuronali e il conseguente deterioramento irreversibile delle funzioni cognitive dei pazienti. Gli oligomeri solubili di Aβ possono subire cambiamenti conformazionali e formare aggregati tossici negli stadi iniziali della malattia, anche molto prima della comparsa di sintomi e segni clinici, e sono stati quindi individuati come bersagli per lo sviluppo di farmaci specifici con l’obiettivo di inibire precocemente il declino delle funzioni cognitive dei pazienti. La Food and Drug Administration (FDA) ha approvato due farmaci a base di anticorpi monoclonali (Aducanumab e Lecanemab), i cui principi attivi sono oggetto di controversie poiché gli studi clinici sinora effettuati mostrano risultati contraddittori. È quindi ancora drammaticamente necessaria la ricerca di una terapia alternativa e non invasiva.
Recentemente, è stata inoltre dimostrata l’efficacia di specifiche molecole fotosensibilizzatrici che attivate dalla luce, sono in grado di produrre ossigeno singoletto ed inibire l'aggregazione e la tossicità degli oligomeri Aβ. Tuttavia, l’utilizzo diretto di questo metodo è impossibile, a causa della limitata penetrazione luca visibile attraverso il cranio e i tessuti.
Il gruppo di ricerca dell’Università di Milano-Bicocca (Dr.ssa Valeria Secchi, Dr.ssa Francesca Cova, Dr.ssa Irene Villa, Prof. Marcello Campione) guidato dal Prof. Angelo Monguzzi, professore di fisica sperimentale della materia del Dipartimento di Scienza dei Materiali, in collaborazione con il Prof. Shai Rahimipour dell'Università di Bar-Ilan in Israele, ha sviluppato una strategia innovativa per superare questa limitazione basata sull’utilizzo di nanotubi scintillanti attivati da basse dosi di raggi X altamente penetranti. I nanotubi scintillanti sono stati funzionalizzati con un fotosensibilizzatore di ossigeno singoletto specifico per gli oligomeri Aβ, riducendo al minimo l'interazione non selettiva con altre biomolecole. La presenza di nanotubi scintillanti favorisce una deposizione localizzata dell’energia trasportata dai raggi X ed un’efficace attivazione del fotosensibilizzatore nel tessuto cerebrale, aumentando così localmente la produzione di ossigeno singoletto in prossimità degli oligomeri Aβ. A seguito dell’irraggiamento a basse dosi di raggi X, l’ossidazione dei monomeri Aβ e degli oligomeri più piccoli impedisce la loro aggregazione nelle forme tossiche. I risultati ottenuti dagli esperimenti in vitro hanno mostrato una significativa riduzione di oltre l'80% dell'aggregazione di Aβ. Gli esperimenti in vivo con modelli animali transgenici di Caenorhabditis (C.) elegans, specifici per la malattia di Alzheimer, hanno dimostrato che la terapia a base di nanotubi scintillanti e raggi X riduce drasticamente la quantità di oligomeri tossici Aβ e determina il recupero delle funzionalità cerebrali e comportamentali associate. La strategia proposta può essere quindi considerata una promettente e rivoluzionaria terapia per combattere la progressione e i sintomi della malattia di Alzheimer.
I risultati della ricerca sono stati pubblicati nell’articolo “Towards non-invasive treatment of Alzheimer’s disease using scintillating nanotubes” (DOI: 10.1002/adhm.202301527) su Advanced Healthcare Materials (Impact Factor 10.0, Journal Citation Report (Clarivate Analytics, 2022)).